
吉晟生技今日宣布韓國最大核醫藥物廠 DuChembio Co., Ltd. 簽署技術轉讓協議,以開發、製造和銷售用於帕金森氏症診斷的放射性藥物,吉晟生將負責該藥物在台上市的全部流程,包括按照 GMP 標準生產、分銷,董事長楊朝堂表示,今年 9 月將提出上市申請,預計明年上半年掛牌。
根據台灣健保局統計,截至 2021 年,台灣帕金森氏症患者總數達 77,428 人,每年新增患者超過 11,000 人,預估今年台灣帕金森氏症患者人數將突破 10 萬人,而 PET 放射性藥物 18F-FP-CIT 是一種能夠透過測量大腦紋狀體內多巴胺轉運體(DAT)密度,協助診斷帕金森氏症的放射性藥物。
楊朝堂表示,相較現有診斷劑, 18F-FP-CIT 具有更高的結合專一性與影像對比度,能夠在症狀出現前就偵測黑質紋狀體通路中的細微退化變化,因此在帕金森氏症診斷方面具有顯著效果,隨著需求的提升,預期這類先進的神經影像診斷技術將受到更多關注。

楊朝堂指出,目前在韓國所進行的上市後監測(PMS)中,針對超過 3,000名患者的研究證實該藥品的安全性與診斷準確性,自核准以來,累計已使用超過 125,000 劑次,幾乎成為韓國臨床現場進行帕金森氏症影像診斷的標準藥物。
楊朝堂分享,DuChemBio 計畫基於 18F-FP-CIT 經過驗證的診斷效能,向吉晟生技提供適用於 GMP 生產的優化前驅物、冷劑組與卡匣,同時提供技術轉移所需的專業知識與當地人員訓練,確保從產品製造到品質管理及批次放行測試等流程皆能順利進行。
楊朝堂說明,吉晟生技與韓國 DuChemBio 合作,預計將該放射性藥物引進台灣市場,同時強化吉晟生技在腦部疾病產品線的布局,預計簽訂協議後 12 個月至 15 個月,吉晟生技將透過技術移轉,向衛福部申請台灣藥證後,按照 GMP 標準生產,最快明年就可望貢獻營運。
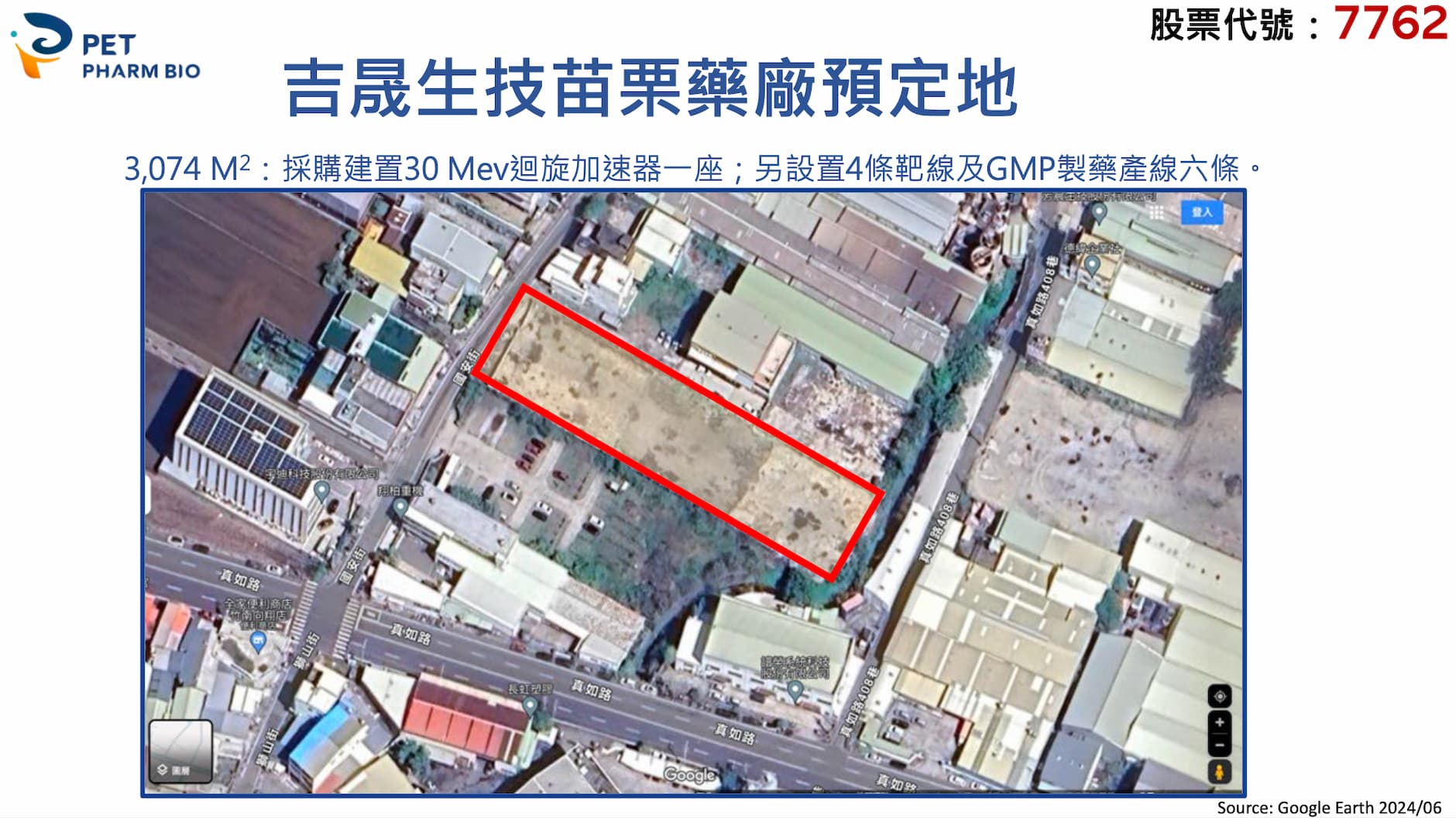
針對產能方面,楊朝堂強調,吉晟今年 3 月以 1.11 億元,取得南部核醫新藥開發禮曼生技 80% 股權,預計今年 7 月交割後,規劃買地設廠以擴充產能,並正在興建苗栗藥廠,預計建置製造放射性藥物的迴旋加速器一座,並設置 4 條靶線及 GMP 製藥產線 6 條,預計最快 2026 年底啟用。
(首圖來源:科技新報)










